 word完整版人教版高二化学选修三同步精选对点训练晶胞的计算Word格式.docx
word完整版人教版高二化学选修三同步精选对点训练晶胞的计算Word格式.docx
- 文档编号:16680809
- 上传时间:2022-11-25
- 格式:DOCX
- 页数:40
- 大小:523.10KB
word完整版人教版高二化学选修三同步精选对点训练晶胞的计算Word格式.docx
《word完整版人教版高二化学选修三同步精选对点训练晶胞的计算Word格式.docx》由会员分享,可在线阅读,更多相关《word完整版人教版高二化学选修三同步精选对点训练晶胞的计算Word格式.docx(40页珍藏版)》请在冰豆网上搜索。
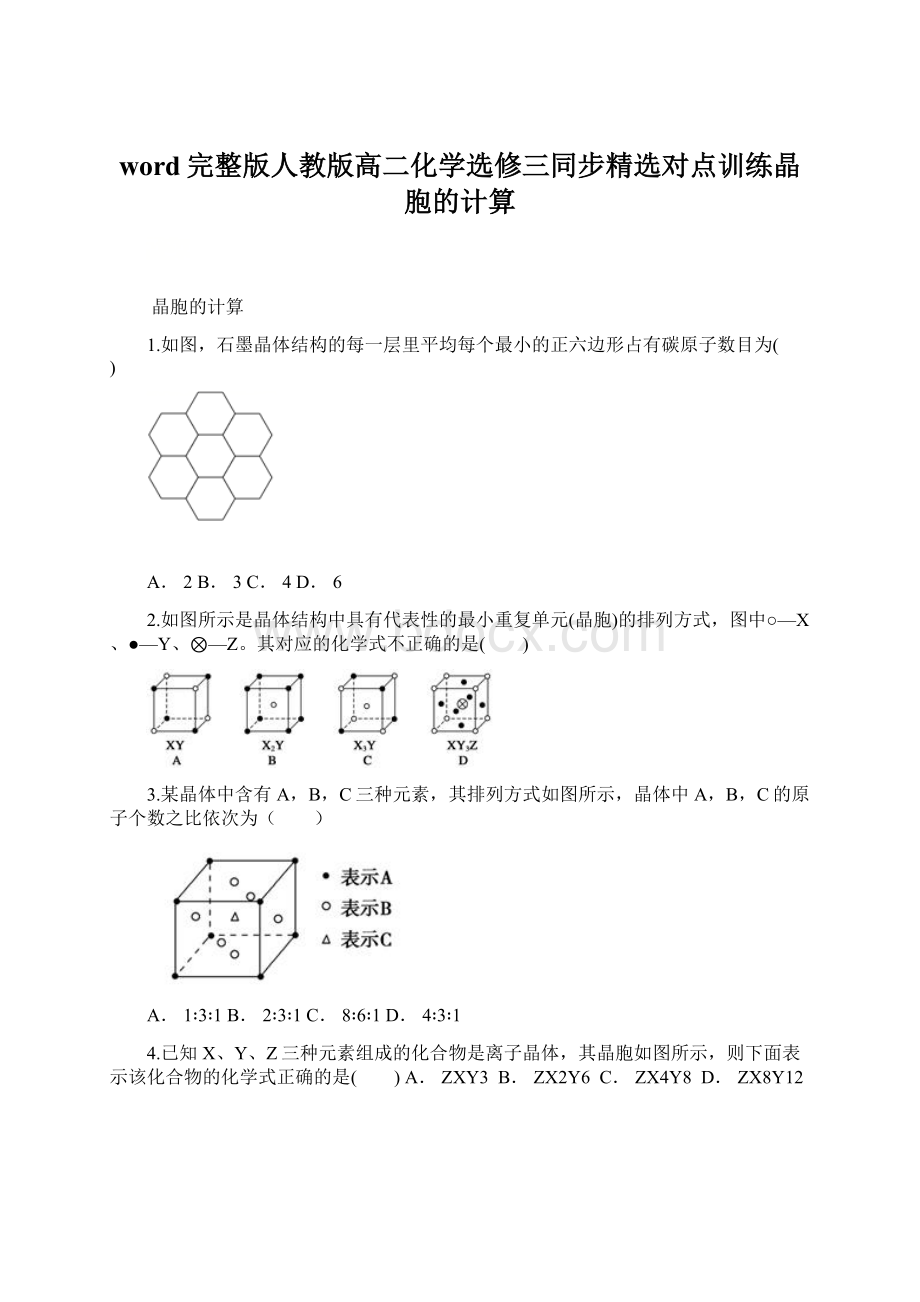
9.科学家发现钇钡铜氧化合物在90K时具有超导性,若该化合物的结构如图所示,则该化合物的化学式可能是()
A.YBa2Cu3O8B.YBa2Cu2O5C.YBa2Cu3O5D.YBaCu4O4
10.某物质的晶体中含有A,B,C三种元素,其排列方式如右图所示(其中前后两面面心中的B元素的原子未能画出)。
晶体中A,B,C的原子个数比为( )
A.1∶3∶1B.2∶3∶1C.2∶2∶1D.1∶3∶3
11.有下列离子晶体的空间结构示意图.图中●和化学式中M分别代表阳离子,图中○和化学式中N分别代表阴离子,则化学式为MN2的晶体结构为( )
A.
B.
C.
D.
12.如图所示的是某原子晶体A空间结构的一个单元,A与某物质B反应生成C,其实质是每个A﹣A键中插入一个B原子,则C物质的化学式为( )
A.ABB.A5B4C.AB2D.A2B5
13.F2和Xe在一定条件下可生成XeF2、XeF4和XeF6三种氟化氙,它们都是极强的氧化剂(其氧化性依次递增),都极易水解,其中:
6XeF4+12H2O═2XeO3+4Xe↑+24HF+3O2↑下列推测正确的是( )
A.XeF2分子中各原子均达到八电子结构
B.某种氟化氙的晶体结构单元如右图,可推知其化学式为XeF6
C.XeF4按已知方式水解,每生成4molXe,转移16mol电子
D.XeF2加入水中,在水分子作用下将重新生成Xe和F2
14.说法正确的是( )
A.124gP4含有的P﹣P键的个数为6NA
B.12g石墨中含有的C﹣C键的个数为2NA
C.12g金刚石中含有的C﹣C键的个数为1.5NA
D.60gSiO2中含Si﹣O键的个数为2NA
15.晶胞是晶体结构中可重复出现的最小的结构单元,C60晶胞结构如图所示,下列说法正确的是( )
A.C60摩尔质量是720 B.C60与苯互为同素异形体
C.在C60晶胞中有14个C60分子
D.每个C60分子周围与它距离最近等距离的C60分子有12个
16.下列有关晶体的叙述中错误的是( )
A.石墨的层状结构中由共价键形成的最小的碳环上有六个碳原子
B.氯化钠晶体中每个Na+周围紧邻的有6个Cl﹣
C.CsCl晶体中每个Cs+周围紧邻的有8个Cl﹣,每个Cs+周围等距离紧邻的有6个Cs+
D.在面心立方最密堆积的金属晶体中,每个金属原子周围紧邻的有4个金属原子
17.2001年报道硼和镁形成的化合物刷新了金属化合物超导温度的最高记录.如图示意的是该化合物的晶体结构单元:
镁原子间形成正六棱柱,且棱柱的上下底面各有一个镁原子,6个硼原子位于棱柱内,则该化合物的化学式可表示为( )
A.MgBB.MgB2C.Mg2BD.Mg3B2
18.晶胞是构成晶体的基本重复单元.在二氧化硅晶胞中有8个硅原子位于立方晶胞的8个顶角,有6个硅原子位于晶胞的6个面心,还有4个硅原子与16个氧原子在晶胞内构成4个硅氧四面体,它们均匀错开排列于晶胞内.根据图示二氧化硅晶胞结构,每个晶胞内所含“SiO2”基元数为( )
A.4个B.6个C.8个D.18个
19.钡在氧气中燃烧时得到一种钡的氧化物晶体,结构如图所示,有关说法不正确的是( )
A.该晶体属于离子晶体 B.晶体的化学式为BaO C.该晶体晶胞结构与NaCl相似
D.与每个Ba2+距离相等且最近的Ba2+共有12个
20.某离子化合物的晶胞结构如图所示,则该晶体中X、Y的离子个数之比是( )
A.4:
1B.1:
1C.2:
1D.1:
2
21.铅、钡、氧形成的某化合物的晶胞结构是:
Pb4+处于立方晶胞顶点,Ba2+处于晶胞中心,O2﹣处于晶胞棱边中心,该化合物化学式为( )
A.BaPbO3B.BaPbO2C.Ba2PbO3D.BaPbO4
22.以共价单键相连的非金属单质中,1个原子与相邻原子成键的数目为8﹣N个,N为该非金属元素的主族序数,化学家称这一现象为(8﹣N)规则.下图是某非金属单质结构模型,构成该单质的元素在元素周期表中位于( )
A.ⅢAB.ⅣAC.ⅤAD.ⅥA
23.钾在氧气中燃烧时得到一种钾的氧化物晶体,其结构如图所示,下列有关说法正确的是( )
A.该氧化物属于离子晶体,其中只含离子键
B.1mol该晶体中含有的离子数目为3NA
C.晶体中与每个K+距离相等且最近的K+共有8个
D.晶体中每个K+同时吸引着6个阴离子
24.如图所示为冰晶石(化学式为Na3AlF6)的晶胞.图中●位于大立方体顶点和面心,○位于大立方体的12条棱的中点和8个小立方体的体心.则下列说法正确的是( )
A.冰晶石的名称是六氟合铝(Ⅲ)化钠B.该物质中存在离子键和共价键
C.大立方体的体心处△代表的是Al3+D.该物质是电解冶炼铝的还原剂
25.某离子晶体的晶体结构示意图如图,晶体中氧的化合价可看作部分为0价,部分为﹣2价.则下列说法错误的是( )
A.晶体中与每个A+距离最近的A+有12个 B.晶体中,阴离子与阳离子个数之比为1:
1
C.该离子晶体化学式为A2O2 D.晶体中,0价氧原子与﹣2价氧原子的数目比为3:
26.某离子晶体的晶体结构中最小重复单元如图所示:
A为阴离子,在正方体内,B为阳离子,分别在顶点和面心,则该晶体的化学式为( )
A.B2AB.BA2C.B7A4D.B4A7
27.钡在氧气中燃烧时得到一种钡的氧化物晶体,结构如图所示,有关说法不正确的是( )
A.该晶体属于离子晶体B.晶体的化学式为Ba2O2
C.该晶体晶胞结构与NaCl相似D.与每个Ba2+距离相等且最近的Ba2+共有12个
28.为了研究问题的方便,我们把在物质晶体立体示意图中处于图中某一位置(如顶点)的一种粒子(如原子、离子或分子)叫做一个质点.在下列各种物质的晶体中与其任意一个质点(原子或离子)存在直接的强烈相互作用的质点的数目表示正确的是( )
A.干冰﹣﹣12B.水晶﹣﹣4C.氯化铯一﹣6D.晶体硅﹣﹣4
29.已知X、Y、Z三种元素组成的化合物是离子晶体,其晶胞如图所示,则下面表示该化合物的化学式正确的( )
A.ZXY3B.ZX2Y6C.ZX4Y8D.ZX8Y12
*30.下列关于晶体的说法正确的组合是( )
①分子晶体中都存在共价键
②在晶体中只要有阳离子就一定有阴离子
③金刚石、Si【C】NaF、NaCl、H2O、H2S晶体的熔点依次降低
④离子晶体中只有离子键没有共价键,分子晶体中肯定没有离子键
⑤CaTiO3晶体中(晶胞结构如图所示)每个Ti4+和12个O2﹣相紧邻
⑥SiO2晶体中每个硅原子与两个氧原子以共价键相结合
⑦晶体中分子间作用力越大,分子越稳定
⑧氯化钠熔化时离子键被破坏.
A.①②③⑥B.①②④C.③⑤⑦D.③⑤⑧
31.下列关于晶体的叙述中错误的是( )
A.金刚石中由共价键形成的最小的碳原子环上有六个碳原子
B.NaCl晶胞中共有4个Na+和4个Cl﹣
C.在CsCl晶体中每个Cs+周围紧邻的有8个Cl﹣,而和每个Cs+等距离紧邻的也有8个Cs+
D.在面心立方最密堆积的金属晶体中,每个金属原子周围紧邻的有12个金属原子
32.如图为冰晶体的结构模型,大球代表O原子,小球代表H原子.下列有关说法正确的是( )
A.冰晶体中每个水分子与另外四个水分子形成四面体
B.冰晶体具有空间网状结构,是原子晶体
C.水分子间通过H﹣O键形成冰晶体
D.冰晶体熔化时,水分子之间的空隙增大
33.硼镁化合物刷新了金属化合物超导温度的最高记录.该化合物晶体结构中的重复结构单元如图所示,12个镁原子间形成正六棱柱,两个镁原子分别在棱柱的上底和下底的中心.六个硼原子位于棱柱内,该化合物的化学式可表示为( )
A.Mg14B6B.MgB2C.Mg9B12D.Mg3B2
34.已知A,B,C,D四种短周期元素在周期表中的相对位置如表,
其中D的原子序数是A的原子序数的3倍.A与D组成的物质是一种超硬耐磨涂层材料,图为其晶体结构中最小的重复结构单元,其中的每个原子最外层均满足8电子稳定结构.下列有关说法正确的是( )
A.A与D组成的物质的化学式为BP,属于离子晶体
B.A与D组成的物质熔点高,且熔融状态下能导电
C.A与D组成的物质中原子间以共价键连接,属于原子晶体
D.A与D组成的化合物晶体中,每个A原子周围连接1个D原子
35.高温下,超氧化钾晶体呈立方体结构.晶体中氧的化合价部分为0价,部分为﹣2价.如图为超氧化钾晶体的一个晶胞(晶体中最小的重复单元).则下列说法正确的是( )
A.超氧化钾的化学式为KO2,每晶胞含有14个K+和13个O2﹣
B.晶体中每个K+周围有8个O2﹣,每个O2﹣周围有8个K+
C.晶体中与每个K+距离最近的K+有8个
D.晶体中,0价氧原子与﹣2价氧原子的数目比为3:
36.最近发现一种钛原子和碳原子构成的气态团簇分子,如图所示,顶角和面心的原子是钛原子,棱的中心和体心的原子是碳原子,它的化学式为( )
A.Ti14C13B.TiCC.Ti4C4D.Ti4C3
*37.测知氯化钠晶体中相邻的Na+与Cl﹣的距离为acm,该晶体密度为dg/cm3,则阿伏加德罗常数可表示为( )
38.钛酸钡的热稳定性好,介电常数高,在小型变压器、话筒和扩音器中都有应用.钛酸钡晶体的晶胞结构示意图如图所示,它的化学式是
A.BaTi8O12B.BaTi4O6C.BaTi2O4D.BaTiO3
39.下列有关晶体的叙述中,错误的是( )
A.金刚石网状结构中,由共价键形成的碳原子环中,最小的环上有6个碳原子
B.氯化钠晶体中,每个Na+周围距离相等且最近的Na+共有6个
C.金属晶体中,以“…ABCABCABC…”形式的堆积称为面心立方堆积
D.干冰晶体中,每个CO2分子周围距离相等且最近的CO2分子共有12个
40.如下图,铁有δ、γ、α三种同素异形体,三种晶体在不同温度下能发生转化.下列说法正确的是( )
A.γFe晶体中与每个铁原子距离相等且最近的铁原子有6个
B.αFe晶体中与每个铁原子距离相等且最近的铁原子有6个
C.将铁加热到1500℃分别急速冷却和缓慢冷却,得到的晶体类型相同
D.三种同素异形体的性质相同
41.(多选)高温下,超氧化钾晶体呈立方体结构,晶体中氧的化合价部分为0价,部分为﹣2价.如图为超氧化钾晶体的一个晶胞(晶体中最小的重复单元),则下列说法中正确的是( )
A.超氧化钾的化学式为KO2,每个晶胞含有4个K+和4个O2-
B.晶体中每个K+周围有8个O2-,每个O2-周围有8个K+
42.(多选)如图为碘晶体晶胞结构.有关说法中正确的是( )
A.碘分子的排列有2种不同的取向,2种取向不同的碘分子以4配位数交替配位形成层结构
B.用均摊法可知平均每个晶胞中有4个碘原子
C.碘晶体为无限延伸的空间结构,是原子晶体
D.碘晶体中的碘原子间存在非极性键和范德华力
43.(多选)根据量子力学计算,氮化碳结构有五种,其中一种氮化碳硬度超过金刚石晶体,成为首届一指的超硬新材料,已知该氮化碳的二维晶体结构如图所示.下列有关氮化碳的说法正确的是( )
A.氮化碳属于分子晶体
B.氮化碳的分了式为C3N4
C.该晶体中的碳、氮原子核外都满足8电子稳定结构
D.每个碳原子与四个氮原子相连,每个氮原子与三个碳原子相连
44.(多选)2010年10月5日17时45分,瑞典皇家科学院宣布,将2010年诺贝尔物理学奖授予英国曼彻斯特大学科学家安德烈?
海姆和康斯坦丁?
诺沃肖洛夫,以表彰他们在石墨烯材料方面的卓越研究.石墨烯是目前科技研究的热点,可看作将石墨的层状结构一层一层的剥开得到的单层碳原子(结构如图所示).将氢气加入到石墨烯中开发出一种具有突破性的新材料石墨烷,下列说法中正确的是( )
A.石墨烯是高分子化合物
B.石墨烯与石墨烷互为同素异形体
C.一定条件下石墨烯可与H2发生加成反应
D.根据结构示意图可知,石墨烯不能导电
45.(多选)过渡元素的化合物是高温超导物质研究的热点.某过渡元素A与氧形成的化合物叫金红石,其晶体的最小结构单元如图.则下面有关金红石的说法正确的是( )
A.一定是共价化合物
B.可能是离子化合物
C.它的化学式为AO2
D.它的化学式为A3O2
46.现有甲、乙、丙(如图)三种晶体的晶胞:
(甲中x处于晶胞的中心,乙中a处于晶胞的中心),可推知:
甲晶体中x与y的个数比是__________________,乙中a与b的个数比是________________,丙晶胞中有_____________个c离子,有___________个d离子。
47.如图所示,在CsCl晶体中,每个Cs+周围与之最接近且距离相等的是Cs+有_________个。
CsCl的晶体结构
48.二氧化硅是立体的网状结构,其晶体模型如下图所示,请认真观察该晶体模型后完成以下问题:
(1)二氧化硅晶体中最小环为___________________元环。
(2)每个硅原子为___________________个最小环共有。
(3)每个最小环平均拥有__________________个硅原子,_________________个氧原子。
49.如图是超导化合物﹣﹣钙钛矿晶体的晶胞结构.请回答:
(1)该化合物的化学式为.
(2)在该化合物晶体中,与钛离子距离最近且相等的钛离子有个.
50.分析化学中常用X射线研究晶体结构.
有一种晶体KxFey(CN)z,其中Fe2+、Fe3+、CN﹣的排布如图所示.每隔一个立方体,在立方体的中心含有一个K+(未画出).
(1)晶体的化学式可表示为.
(2)1mo
lKxFey(CN)z晶体中含π键 mol.
51.某离子晶体晶胞结构如图所示,x位于立方体的顶点,Y位于立方体中心.试分析:
该晶体的化学式为.
52.一种离子晶体的晶胞如图其中阳离子A以红球表示,阴离子B以黑球表示.
(1)每个晶胞中含A离子的数目为,含B离子数目为。
(2)若A的核外电子排布与Ar相同,B的电子排布与Ne相同,则该离子化合物的化学式是;
(3)阳离子周围距离最近的阴离子数为,阴离子周围距离最近的阳离子数。
(4)已知A的离子半径为rm,则该晶胞的体积是 m3。
53.一种Al﹣Fe合金的立体晶胞如图所示.确定该合金的化学式
54.Al单质晶体中其晶体最小重复单元特征如图所示,请回答:
晶体中距离Al原子最近的A1原子为个,一个最小单元结构中Al原子的数目为.
55.纯铜在工业上主要用来制造导线、电器元件等,铜能形成+1和+2价的化合物.回答下列问题:
(1)写出基态Cu+的核外电子排布式:
;
C、N、O三种元素的第一电离能由大到小的顺序是
(2)如图是铜的某种氧化物的晶胞示意图,该氧化物的化学式为.
56.如图,直线交点处的圆圈为NaCl晶体中Na+或Cl﹣所处的位置,这两种离子在空间三个互相垂直的方向上都是等距离排列的.
(1)请将其中代表Na+的圆圈涂黑(不必考虑体积大小),以完成NaCl晶体结构示意图.
(2)晶体中,在每个Na+的周围与它最接近的且距离相等的Na+共有个.
(3)晶体中每一个重复的结构单元叫晶胞.在NaCl晶胞中正六面体的顶点上、面上、棱上的Na+或Cl﹣为该晶胞与其相邻的晶胞所共有,一个晶胞中Cl﹣的个数等于,即(填计算式);
Na+的个数等于 ,即(填计算式) .
57.
(1)氯化铝常温下为固体,熔点190℃(253kPa),易升华.实验室氯化铝蒸气的密度为11.92g•L﹣1(已折算成标准状况),据此判断氯化铝晶体为 晶体,其分子式为.
(2)氧化镁晶体的晶胞结构与NaCl晶体的晶胞结构相同.则氧化镁晶体中阴离子的配位数为个;
氧化镁晶体的熔点比NaCl高的原因是.
(3)金属铁的晶体在不同温度下有如图的两种堆积方式,面心立方晶胞和体心立方晶胞中的Fe原子的配位数之比为 ;
两种堆积方式中密度较大的是 立方堆积.
58.砷化镓属于第三代半导体,它能直接将电能转变为光能,砷化镓灯泡寿命是普通灯泡的100倍,而耗能只有其10%,推广砷化镓等发光二极管(LED)照明,是节能减排的有效举措.已知砷化镓的晶胞结构如图.试回答下列问题:
(1)砷化镓的化学式,镓原子的配位数为.
(2)下列说法正确的是()(填字母).
A.砷化镓晶胞结构与NaCl的相同B.GaP、SiC与砷化镓的价电子总数相等
59.元素W是Cu元素,其一种氯化物晶体的晶胞结构如图所示,该氯化物的化学式是,它可与浓盐酸发生非氧化还原反应,生成配合物HnWCl3,反应的化学方程式为。
60.现有甲、乙、丙(如图)三种晶体的晶胞(甲中x处于晶胞的中心,乙中a处于晶胞的中心),可推知:
甲晶胞中x与y的个数比是__________,乙晶胞中a与b的个数比是__________,丙晶胞中有________个c离子,有________个d离子。
61.某晶体的晶胞结构如图所示。
X(•)位于立方体顶点,Y(○)位于立方体中心。
试分析:
(1)晶体中每一个Y同时吸引着______个X,每个X同时吸引着________个Y,该晶体的化学式是__________。
(2)晶体中在每个X周围与它最接近且距离相等的X共有______个。
(3)晶体中距离最近的2个X分别与1个Y形成的两条线的夹角为____________。
62.元素X的某价态离子Xn+中所有电子正好充满K、L、M三个电子层,它与N3-形成晶体的晶胞结构如图所示。
(1)该晶体的阳离子与阴离子个数比为________。
(2)该晶体中Xn+中n=____________。
(3)X元素的原子序数是________。
(4)晶体中每个N3-被________个等距离的Xn+包围。
63.有一种蓝色的晶体,它的结构特征是Fe2+和Fe3+分别占据晶胞立方体互不相邻的顶点,立方体的每条棱上均有一个CN-。
(1)根据晶体结构的特点,推出这种蓝色晶体的化学式(用简单整数表示)______________。
(2)此化学式带何种电荷__________,如果Rn+或Rn-与其结合成电中性粒子,此粒子的化学式为________________。
64.A,B,C,D、E都是元素周期表中前20号元素,其原子序数依次增大.B,C,D同周期,A,D同主族,E和其它元素既不在同周期也不在同主族.B,C,D的最高价氧化物的水化物均能互相反应生成盐和水.A和E可形成离子化合物,其晶胞结构如下图所示:
(1)A和E所形成的化合物的电子式是
(2)A,B,C,D四种元素的原子半径由小到大的顺序为 F<Cl<Al<Na (用元素符号表示)
(3)A和D的氢化物中,后者沸点较低,原因是 由于HF分子间存在氢键
(4)A和E的化合物晶体中,每个阳离子的周围与它最近且等距离的阳离子共有 12 个
(5)已知A和E所形成的化合物晶体的晶胞体积为1.6×
10﹣22cm3,则A和E组成的离子化合物的密度为(结果保留一位小数)3.2g/cm3 .
65.有下列离子晶体立体构型示意图如下图所示。
(1)以M代表阳离子,以N代表阴离子,写出各离子晶体的组成表达式。
A.__________,B:
________,C:
________,D:
__________________________。
(2)已知FeS2晶体(黄铁矿的主要成分)具有A的立体结构。
①FeS2晶体中具有的化学键类型是__________________________________________。
②若晶体结构A中相邻的阴、阳离子间的距离为acm,且用NA代表阿伏加德罗常数,则FeS2晶体的密度是________g·
cm-3。
66.下图是金属钨晶体中的一个晶胞的结构示意图,它是一种体心立方结构。
实验测得金属钨的密度为19.30g·
cm-3,钨的相对原子质量是183.9。
假设金属钨原子为等径刚性球,试完成下列问题:
(1)每一个晶胞中均摊到________个钨原子。
(2)计算晶胞的边长a。
(3)计算钨的原子半径r(提示:
只有体对角线上的各个球才是彼此接触的)。
67.NaCl晶体中Na+与Cl-都是等距离交错排列,若食盐的密度是2.2g·
cm-3,阿伏加德罗常数为6.02×
1023mol-1,食盐的摩尔质量为58.5g·
mol-1。
则食盐晶体中两个距离最近的钠离子中心间的距离是多少?
68.
(1)NiO(氧化镍)晶体的结构与NaCl
- 配套讲稿:
如PPT文件的首页显示word图标,表示该PPT已包含配套word讲稿。双击word图标可打开word文档。
- 特殊限制:
部分文档作品中含有的国旗、国徽等图片,仅作为作品整体效果示例展示,禁止商用。设计者仅对作品中独创性部分享有著作权。
- 关 键 词:
- word 完整版 人教版高二 化学 选修 同步 精选 训练 晶胞 计算
 冰豆网所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。
冰豆网所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。


 《雷雨》中的蘩漪人物形象分析 1.docx
《雷雨》中的蘩漪人物形象分析 1.docx
