 高中化学专题2从海水中获得的化学物质第一单元氯溴碘及其化合物第5课时溴碘的提取学案苏教版必修1文档格式.docx
高中化学专题2从海水中获得的化学物质第一单元氯溴碘及其化合物第5课时溴碘的提取学案苏教版必修1文档格式.docx
- 文档编号:22769451
- 上传时间:2023-02-05
- 格式:DOCX
- 页数:19
- 大小:152.80KB
高中化学专题2从海水中获得的化学物质第一单元氯溴碘及其化合物第5课时溴碘的提取学案苏教版必修1文档格式.docx
《高中化学专题2从海水中获得的化学物质第一单元氯溴碘及其化合物第5课时溴碘的提取学案苏教版必修1文档格式.docx》由会员分享,可在线阅读,更多相关《高中化学专题2从海水中获得的化学物质第一单元氯溴碘及其化合物第5课时溴碘的提取学案苏教版必修1文档格式.docx(19页珍藏版)》请在冰豆网上搜索。
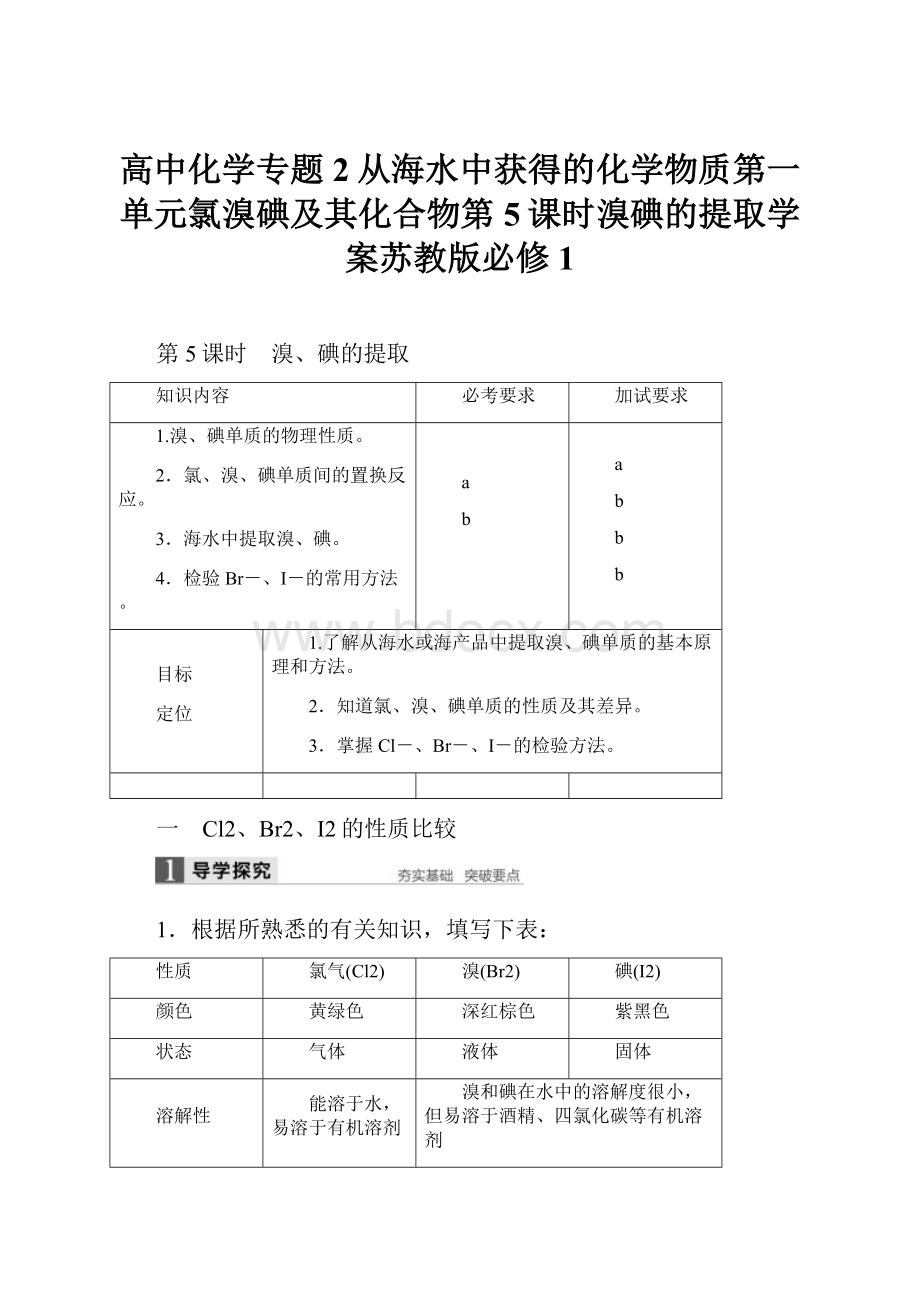
水中浅黄绿色,CCl4中黄绿色
水中黄→橙,
CCl4中橙→橙红
水中棕→褐,
CCl4中紫→紫红
2.Cl2、Br2、I2的氧化性比较
(1)NaBr溶液
溶液由无色变为橙色
溶液分层,下层液体呈橙红色。
化学方程式为2NaBr+Cl2===2NaCl+Br2。
结论:
氧化性:
Cl2>Br2。
(2)KI溶液
溶液由无色变为褐色
溶液分层,下层液体呈紫红色。
化学方程式为2KI+Cl2===2KCl+I2。
Cl2>I2。
(3)KI溶液
化学方程式为2KI+Br2===2KBr+I2。
Br2>I2。
3.将下列各实验中的现象填入下表(加试要求):
实验现象
滴入几滴AgNO3溶液
加入少量稀硝酸
①NaCl溶液
有白色沉淀生成
沉淀不溶解
②NaBr溶液
有淡黄色沉淀生成
③NaI溶液
有黄色沉淀生成
(1)请写出实验中的化学方程式:
①NaCl+AgNO3===AgCl↓+NaNO3;
②NaBr+AgNO3===AgBr↓+NaNO3;
③NaI+AgNO3===AgI↓+NaNO3。
(2)卤化银(AgCl、AgBr、AgI)沉淀的颜色不同,可用硝酸酸化的AgNO3溶液来检验卤素离子。
归纳总结
Cl2、Br2、I2的性质比较
(1)卤素单质(Cl2、Br2、I2)的氧化性由强到弱的顺序是Cl2>Br2>I2;
卤素离子(Cl-、Br-、I-)的还原性由强到弱的顺序是I->Br->Cl-。
(2)卤素离子X-(Cl-、Br-、I-)的检验(加试要求)
①AgNO3溶液—稀HNO3法
②氯水—CCl4法
③氯水—淀粉法
溶液变蓝色…I-
1.甲、乙、丙三种溶液中各含有一种X-(X-为Cl-、Br-或I-),往甲中加入淀粉溶液和氯水,则溶液变为橙色,再往此溶液中加入丙溶液,颜色无明显变化。
则甲、乙、丙依次含有( )
A.Br-、I-、Cl-B.Br-、Cl-、I-
C.I-、Br-、Cl-D.Cl-、I-、Br-
答案 A
解析 由题目给定条件“往甲中加入淀粉溶液和氯水,则溶液变为橙色”知:
甲溶液中只有Br-,且加入氯水后,生成Br2使溶液显橙色。
显然,若把此溶液加到含I-的溶液中,将会因生成碘单质而使溶液变蓝色(因为第一步往溶液中加了淀粉溶液)。
再往此溶液中加入丙溶液,颜色没有明显变化,说明丙中无I-。
2.(加试要求)向某无色溶液中通入一定量的氯气后,溶液变成橙黄色,再向溶液中滴加一定量的四氯化碳溶液后,充分振荡,溶液分层,下层呈橙红色,则原溶液中一定含有的离子为( )
A.Cl-B.Br-C.I-D.Fe2+
答案 B
解析 此题是对Cl2的强氧化性和Br2、I2的物理性质的综合性考查。
解题过程中一定要明确四氯化碳溶液的作用和Br2、I2在四氯化碳溶液中的不同颜色,防止因混淆而错解。
值得注意的是,Fe3+的水溶液也为黄色,但Fe3+不溶于四氯化碳溶液,且Fe2+的水溶液为浅绿色。
二 从海水或海产品中提取溴和碘(加试要求)
1.在海水中溴以溴化镁和溴化钠的形式存在。
经过晒盐后的卤水中,溴的含量提高了100倍左右。
只要把卤水加入反应塔中,通过氯气和水蒸气蒸馏,就可以把“溴”蒸出来。
也可以借助煤油从海水中提取溴,煤油用过之后,还可以回收。
(1)从海水中提取溴,一般要经过浓缩、氧化和提取三个步骤。
其流程为
(2)卤水中通入Cl2时发生反应的化学方程式为2NaBr+Cl2===2NaCl+Br2。
(3)通过水蒸气就可把溴蒸出来的原因是溴单质易挥发。
(4)借助煤油从海水中提取溴是利用了溴易溶于有机溶剂的性质。
2.海洋植物如海带、海藻中含有丰富的碘元素,燃烧的灰烬中碘元素以I-的形式存在。
实验室里从海藻中提取碘的流程如下:
(1)指出提取碘的过程中有关的实验操作名称:
①____________;
③____________;
写出实验②中有关反应的化学方程式(设含I-的溶液为NaI溶液):
_______________________________________________________________
________________________________________________________________________。
(2)提取碘的过程中,可供选择的有机试剂是______(填字母)。
A.苯、酒精B.四氯化碳、苯
C.汽油、乙酸D.汽油、甘油
(3)为使海藻灰中I-转化为碘的有机溶液,实验室里有烧杯、玻璃棒、集气瓶、酒精灯、导管、圆底烧瓶、石棉网以及必要的夹持仪器、物品,尚缺少的玻璃仪器是____________________。
答案
(1)过滤 萃取分液 2NaI+Cl2===2NaCl+I2
(2)B (3)分液漏斗、漏斗
1.海水提溴
2.海产品提碘
干海带
浸泡液
滤液
氧化
粗碘
碘单质
3.海带中含有丰富的碘,有人设计如下步骤:
①将海带灼烧成灰,在灰中加水搅拌;
②加四氯化碳充分振荡静置;
③通入氯气;
④过滤;
⑤用分液法分离液体混合物。
合理操作的先后顺序是( )
A.①②③④⑤B.①④②③⑤
C.①②④③⑤D.①④③②⑤
答案 D
解析 海带烧成灰后,有不溶性的物质,需经过过滤,过滤之后,需通入适量氯气将I-氧化为I2,再萃取分液。
4.某同学为了验证海带中含有碘,拟进行如下实验,请回答相关问题。
(1)第1步:
灼烧。
操作是将足量海带灼烧成灰烬,该过程中将使用到的瓷质或玻璃质实验仪器有__________________________(填代号,限填3项)。
A.试管 B.瓷坩埚 C.坩埚钳 D.铁三脚架
E.泥三角F.酒精灯G.烧杯H.量筒
(2)第2步:
I-溶液的获取。
操作是_____________________________________________。
(3)第3步:
氧化。
操作是依次加入合适的试剂,下列氧化剂最好选用________(填字母)。
A.浓硫酸B.新制氯水
C.KMnO4溶液D.H2O2
理由是________________________________________________________________________。
(4)碘单质的检验。
操作是__________________________________________________。
答案
(1)BEF
(2)将灰烬转移到烧杯中,加适量蒸馏水,用玻璃棒充分搅拌,煮沸,过滤
(3)D 过氧化氢是绿色氧化剂,在氧化过程中不引进杂质、不产生污染(不会进一步氧化单质碘)
(4)取少量第3步后的溶液,滴加淀粉溶液,如果溶液显蓝色,则证明海带中含碘
解析
(1)灼烧操作须用到的仪器有酒精灯、瓷坩埚、铁三脚架、泥三角、坩埚钳等,其中瓷质和玻璃实验仪器是酒精灯、瓷坩埚和泥三角。
(2)应用适量蒸馏水溶解,充分搅拌,再过滤即可。
(3)主要从氧化过程中不引进杂质、不产生污染,以及不能氧化碘等角度考虑,如新制氯水虽然能氧化I-,但只能适量,过量的氯水会继续氧化单质碘。
1.下列说法正确的是( )
A.碘易升华,可保存在酒精中
B.液溴应保存在棕色磨口玻璃塞的试剂瓶中,并加少量水进行水封
C.新制的氯水长期保存在无色玻璃瓶中
D.用酒精可以从碘水中萃取碘
解析 碘易溶于酒精,所以不能保存在酒精中;
新制氯水应保存在棕色瓶内,且不能长期保存;
酒精易溶于水,不能从碘水中萃取出碘。
2.(加试要求)在盛有KI溶液的试管中,滴入氯水充分反应后,再加CCl4溶液振荡,静置后观察到的现象是( )
A.上层紫红色,下层接近无色
B.均匀、透明、紫红色
C.均匀、透明、无色
D.上层接近无色,下层紫红色
3.将适量的Cl2通入溴化钠溶液中,等反应停止后,实验室从该溶液中提取溴通常所需的主要仪器和方法是( )
A.蒸发皿:
蒸发后灼烧
B.烧杯:
冷却、结晶、过滤
C.分液漏斗:
分液
D.分液漏斗:
加萃取剂,振荡静置分层后分液
解析 反应停止后,溶液中存在Br2、NaCl等溶质,需采用合适的有机溶剂(如苯、CCl4等)来萃取Br2,采用分液操作来完成溴的提取。
4.海藻中含有丰富的碘元素。
下面是实验室从海藻里提取碘的流程的一部分。
下列判断正确的是( )
A.步骤④的操作是过滤
B.可用淀粉溶液检验步骤②的反应是否进行完全
C.步骤①、③的操作分别是过滤、萃取
D.步骤③中加入的有机溶剂可以是酒精或CCl4
答案 C
解析 A项,碘易溶于有机溶剂,所以不能用过滤的方法提取碘,应该用蒸馏的方法提取碘;
B项,淀粉遇I2变蓝,遇I-不变色,因此不能用淀粉检验I-;
C项,分离固体和液体混合物的方法为过滤,从水溶液中提取碘一般用萃取的方法,步骤①、③的操作分别是过滤、萃取,正确;
D项,萃取剂和原溶剂不能互溶,而酒精能与水互溶,故酒精不能作此步骤中的萃取剂。
5.(加试要求)为检验某碳酸钠溶液中混有的溴化钠,进行如下实验:
(1)取样,加入过量的稀硝酸,其目的是_________________________________________。
(2)加入硝酸银溶液,观察到的现象是______________,反应的化学方程式是________________________________________________________________________。
答案
(1)除去CO
,防止Na2CO3对NaBr检验的干扰
(2)产生淡黄色沉淀 AgNO3+NaBr===AgBr↓+NaNO3
6.(加试要求)海水是巨大的资源宝库,从海水中提取食盐和溴的过程如下:
(1)将NaCl溶液进行电解,在电解槽中可直接得到的产品有H2、__________、__________或H2、__________。
(2)步骤Ⅱ用SO2水溶液吸收Br2,可制得HBr和硫酸,该反应中,氧化剂是____________(填化学式,下同),氧化产物是____________。
(3)写出步骤Ⅲ反应的化学方程式____________________________________________。
答案
(1)Cl2 NaOH NaClO
(2)Br2 H2SO4
(3)Cl2+2HBr===2HCl+Br2
课时作业
[经典基础题]
1.(加试要求)在盛有溴水的三支试管中分别加入苯、四氯化碳和酒精,振荡后静置,出现如图所示现象。
正确的结论是( )
A.①加入的是四氯化碳,②加入的是苯,③加入的是酒精
B.①加入的是酒精,②加入的是四氯化碳,③加入的是苯
C.①加入的是苯,②加入的是四氯化碳,③加入的是酒精
D.①加入的是苯,②加入的是酒精,③加入的是四氯化碳
解析 四氯化碳的密度比水大,苯的密度比水小,酒精与水以任意比互溶。
据此可判断①加入的是苯,②加入的是四氯化碳,③加入的是酒精。
2.欲将食盐固体与碘的混合物分开,最好的方法是( )
A.溶解、过滤
B.溶解、过滤、蒸发
C.溶解、加AgNO3溶液、过滤
D.加热使碘升华
3.(加试要求)从海水中可以提取溴,但得到的液溴中常常溶有少量氯气,除去氯气应该采用的方法是( )
A.加入适量的Na2CO3溶液B.通入溴蒸气
C.加入适量的NaOH溶液D.加入适量的NaBr溶液
解析 Na2CO3溶液和NaOH溶液都能与溴反应,不能用于除杂。
4.实验室从海带中提取碘的操作过程中,仪器选用不正确的是( )
选项
A
B
C
D
操作
称取3g左右的剪碎了的干海带
灼烧干海带碎片至完全变成灰烬
过滤煮沸后的海带灰与水的混合液
用四氯化碳从氧化后的海带灰浸取液中提取碘
选用
仪器
解析 应在坩埚中灼烧海带。
5.向含有KBr、NaI的混合溶液中通入过量的Cl2充分反应后,将溶液蒸干并进行灼烧,最后所得的固体物质是( )
A.NaCl和KClB.KCl和NaBr
C.NaCl和KID.NaCl、KCl和I2
解析 通入过量的氯气先后发生反应:
Cl2+2NaI===2NaCl+I2,Cl2+2KBr===2KCl+Br2;
蒸干并灼烧后,单质溴和碘均逸出,所得固体为NaCl和KCl。
6.某溶液中阳离子只含K+,其中Cl-、Br-、I-的个数比为1∶2∶3,欲使这些离子个数比变为3∶2∶1,需要通入的氯气分子与原溶液中I-的个数比应为( )
A.1∶2B.2∶1
C.1∶3D.3∶1
解析 将比例看成具体数字,即3种微粒分别是1mol、2mol、3mol,反应后Br-的物质的量不变,又剩余1molI-,说明氯气只和I-发生了反应,且只反应掉2molI-,化学方程式是Cl2+2KI===2KCl+I2,每反应掉2molI-时,消耗1molCl2。
7.(加试要求)已知常温下氯酸钾与浓盐酸反应放出氯气,现按下图进行卤素的性质实验。
玻璃管内装有分别滴有不同溶液的白色棉球,反应一段时间后,对图中指定部位颜色描述正确的是( )
①
②
③
④
橙色
蓝色
白色
无色
紫色
解析 Cl2是黄绿色气体,故①处呈黄绿色;
②处反应:
Cl2+2NaBr===2NaCl+Br2,溴水呈橙色;
③处反应:
Cl2+2KI===2KCl+I2,淀粉遇I2变蓝色;
④处反应:
Cl2+2NaOH===NaCl+NaClO+H2O,棉球仍呈白色。
8.(加试要求)在少量氯水的试管中加入过量的溴化钾溶液,再加少量CCl4,振荡静置后( )
A.水溶液为紫色B.CCl4层为橙红色
C.CCl4层为紫红色D.水溶液为橙色
9.(加试要求)下列叙述中正确的是( )
A.液溴易挥发,在存放液溴的试剂瓶中应加水液封
B.能使润湿的淀粉KI试纸变成蓝色的物质一定是Cl2
C.某溶液加入CCl4,CCl4层呈紫色,证明原溶液中存在I-
D.某溶液加入BaCl2溶液,产生不溶于稀硝酸的白色沉淀,该溶液中一定含有Ag+
解析 选项A,在存放液溴的试剂瓶中加水液封,可减少溴的挥发,A正确;
选项B,能使润湿的淀粉KI试纸变成蓝色的物质不一定是Cl2,也可能是O3、溴蒸气、NO2等,B错误;
某溶液加入CCl4,CCl4层呈紫色,证明原溶液中存在I2,C错误;
选项D,不溶于稀硝酸的白色沉淀可能是BaSO4,也可能是AgCl,所以原溶液中可能含有Ag+,也可能含有SO
,D错误。
10.(加试要求)溴化碘(IBr)的化学性质很像卤素的单质,它能与大多数金属、非金属化合生成卤化物,也能与水发生如下反应:
IBr+H2O===HBr+HIO。
下列有关IBr的叙述中不正确的是( )
A.在很多反应中是强氧化剂
B.在与水反应时既作氧化剂,又作还原剂
C.IBr与AgNO3溶液反应会生成AgBr沉淀
D.IBr与NaOH反应时,生成NaBr和NaIO
解析 此题是一道信息题,题中给出了三个信息:
①化学式IBr暗示Br元素呈-1价,I元素呈+1价;
②IBr性质与卤素单质相似;
③IBr与水反应生成HBr和HIO。
由③可知IBr是一种强氧化剂。
再结合④可知IBr与H2O的反应是一个复分解反应,而不是氧化还原反应。
[能力提升题]
11.(加试要求)某化学研究性学习小组为了解从工业溴中提纯溴的方法,查阅了有关资料:
Br2的沸点为59℃,微溶于水,有毒性和强腐蚀性。
他们参观生产过程后,绘制了如下装置简图:
请你参与分析讨论:
(1)图中仪器B的名称为________。
(2)整套实验装置中仪器连接均不能用橡胶塞和橡胶管,其原因为_____________________。
(3)实验装置气密性良好,要达到提纯溴的目的,操作中如何控制关键条件:
(4)C中液体产物颜色为________,为除去该产物中仍残留的少量Cl2,可向其中加入NaBr溶液,充分反应后,再进行的分离操作是______________________________________________。
(5)D装置的作用是___________________________________________________________。
答案
(1)冷凝管
(2)Br2腐蚀橡胶
(3)控制温度计b的温度、并收集59℃时的馏分
(4)深红棕色 萃取、分液(或蒸馏)
(5)除去少量有毒性的溴蒸气,防止污染空气
解析 图中从工业溴中提纯溴的方法是蒸馏法,先将烧瓶在热水浴中加热到59℃,此时液溴变成溴蒸气,经过冷凝管冷却得到液溴。
因为溴有强腐蚀性,所以装置中仪器连接均不能用橡胶塞和橡胶管;
因为溴易挥发而且有毒性,所以D装置是尾气吸收装置,目的是除去少量有毒性的溴蒸气,防止污染空气。
向残留少量Cl2的液溴中加入NaBr溶液,发生反应:
Cl2+2NaBr===2NaCl+Br2,然后加入苯或四氯化碳等有机溶剂萃取、分液即可得到溴的有机溶剂溶液,然后用图中的装置再进行一次蒸馏,将溴和有机溶剂分离,这样得到的溴纯度更高。
12.(加试要求)氯水可以跟KI溶液发生置换反应,过量的氯水还可将碘氧化为碘酸(HIO3),其化学方程式为5Cl2+I2+6H2O===2HIO3+10HCl。
已知碘酸是一种无色晶体极易溶于水。
现有一瓶无色溶液,请用氯水和四氯化碳为试剂,检验其中含有的Br-和I-,写出有关的实验步骤和现象:
(1)________________________________________________________________________
(2)________________________________________________________________________
(3)________________________________________________________________________
答案
(1)先取少量无色溶液于试管中,加入适量CCl4,然后逐滴加入氯水,边滴加边振荡,若CCl4层有浅紫色出现,则证明原溶液中含有I-
(2)将上述溶液静置,待液体明显分层后,取上层清液于另一支试管中
(3)向取出的清液中加入过量的氯水,再加入适量的CCl4,振荡、静置,若液体分层后CCl4层呈现橙色,则证明原溶液中有Br-
解析 分析题意可知,问题的关键是如何用氯水分别检验出Br-和I-的存在。
由于I-的还原性强于Br-,I-必先被氯水氧化,但因I2可跟过量的氯水进一步反应,加入过量的氯水后,用四氯化碳检验出的只可能是溴。
因此必须考虑通过控制加入氯水的量来分步检验出I-和Br-。
13.(加试要求)溴是海水中的重要元素,海水中溴元素的含量一般为0.067g·
L-1,晒盐浓缩后的苦卤中含有浓度较高的溴离子,所以可以利用苦卤提取溴,实验室模拟工业制取溴的流程如下:
请回答下列问题:
(1)用CCl4从混合液B中萃取Br2,原理是____________________________________
________________________________________________________________________
________________________________________________________________________,
含Br2的CCl4溶液应从分液漏斗的________口放出。
(2)通入热空气的目的是____________________________________________________。
(3)写出下列反应的化学方程式:
①苦卤液(主要成分为KBr)中通入Cl2:
_______________________________________
________________________________________________________________________;
②混合液A用H2SO4酸化:
________________________________________________
答案
(1)Br2在CCl4中的溶解度远大于在水中的溶解度,同时Br2与CCl4不反应,且CCl4与水不互溶、不反应,密度相差较大 下
(2)将Br2从溶液中吹出来,富集Br2
(3)①2KBr+Cl2===Br2+2KCl
②5NaBr+NaBrO3+3H2SO4===3Br2+3Na2SO4+3H2O
14.(加试要求)空气吹出法工艺,是目前“海水提溴”的最主要方法之一。
其工艺流程如下:
(1)步骤③的化学方程式:
____________________________________________________。
(2)步骤⑤中溴蒸气冷凝后得到液溴与溴水的混合物,可利用它们的相对密度相差很大的特点进行分离。
分离仪器的名称是________。
(3)溴水混合物Ⅱ中溶有一定量的氯气,因此在步骤⑤中可将蒸馏产生的
- 配套讲稿:
如PPT文件的首页显示word图标,表示该PPT已包含配套word讲稿。双击word图标可打开word文档。
- 特殊限制:
部分文档作品中含有的国旗、国徽等图片,仅作为作品整体效果示例展示,禁止商用。设计者仅对作品中独创性部分享有著作权。
- 关 键 词:
- 高中化学 专题 海水 获得 化学物质 第一 单元 氯溴碘 及其 化合物 课时 提取 学案苏教版 必修
 冰豆网所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。
冰豆网所有资源均是用户自行上传分享,仅供网友学习交流,未经上传用户书面授权,请勿作他用。
链接地址:https://www.bdocx.com/doc/22769451.html


 1212中级汽车维修工考试试题三.docx
1212中级汽车维修工考试试题三.docx
